مقدمات بیوشیمی
در این سریآموزشهای لینوم، قصد داریم تا با هم به بررسی مفاهیم مختلف دربیوشیمی بپردازیم و در این مقاله ابتدا تعاریف اولیه را توضیح میدهیم.
- ﺳﻠﻮل: واﺣﺪ ﺳﺎﺧﺘﻤﺎﻧﻲ ﺳﻴﺴﺘﻢﻫﺎي ﺣﻴﺎﺗﻲ را ﺗﺸﻜﻴﻞ ﻣﻲدﻫﺪ ﺑﻨﺎﺑﺮاﻳﻦ ﺷﻨﺎﺧﺖ ﺳﻠﻮل و ﺳﻠﺴﻠﻪ ﻣﺮاﺗـﺐ ﺗﻜﺎﻣـﻞ ﻣﻮﻟﻜـﻮﻟﻲ در ﺳـﺎﺧﺘﻤﺎنﺳﻠﻮل از ﻣﻮﺿﻮﻋﺎت اﺻﻠﻲ ﻣﻲﺑﺎﺷﻨﺪ.
ﻫﻤﻪ اﻧﻮاع درﺷﺖ ﻣﻮﻟﻜﻮل اﺻﻠﻲ در ﺗﻤﺎم ﺳﻠﻮلﻫﺎ ﺗﻘﺮﻳﺒﺎً ﺑﻪ ﻳﻚ ﻧﺴﺒﺖ وﺟﻮد دارﻧﺪ و ﻫﺮﻳﻚ وﻇﻴﻔـﻪي ﻣﺸﺨـﺼﻲ را در ﺳـﻠﻮل ﺑﺮﻋﻬـﺪهدارﻧﺪ.
-اﺳﻴﺪﻫﺎي ﻧﻮﻛﻠﺌﻴﻚ: ﺣﺎﻣﻞ اﻃﻼﻋﺎت ﺗﻮارﺛﻲ در ﺳﻠﻮلﻫﺎ ﺑﻮده و ﻧﻘﺶ ﻣﻬﻤﻲ در ﺣﻤﻞ اﻳﻦ اﻃﻼﻋﺎت دارا ﻣﻲﺑﺎﺷﺪ. ﻣﺤﺼﻮل ﺑﻴﺎناﻃﻼﻋﺎت ﺗﻮارﺛﻲ ﭘﺮوﺗﺌﻴﻦﻫﺎ ﻣﻲ ﺑﺎﺷﻨﺪ.
-ﭘﺮوﺗﺌﻴﻦﻫﺎ: ﻣﻮﻟﻜﻮلﻫﺎﻳﻲ ﻫﺴﺘﻨﺪ ﻛﻪ ﺑﻴﺸﺘﺮ ﻧﻘﺶ آﻧﺰﻳﻤﻲ و ﻫﻢ ﭼﻨﻴﻦ ﻧﻘﺶ ﺳﺎﺧﺘﻤﺎﻧﻲ در ﺳﻠﻮل دارﻧﺪ.
- ﭘﻠﻲ ﺳﺎﻛﺎرﻳﺪﻫﺎ: ﻣﻲ ﺗﻮاﻧﻨﺪ در ﺳﻠﻮل ﻧﻘﺶ ذﺧﻴﺮهاي (ﮔﻠﻴﻜﻮژن– ﻧﺸﺎﺳﺘﻪ) و ﻳﺎ ﻧﻘﺶ ﺳﺎﺧﺘﻤﺎﻧﻲ (ﺳﻠﻮﻟﺰ) را داﺷﺘﻪ ﺑﺎﺷﻨﺪ.
-ﻟﻴﭙﭙﻴﺪﻫﺎ: در ذﺧﻴﺮهي اﻧﺮژي و در ﺳﺎﺧﺘﺎر ﻏﺸﺎ ﻛﺎرﺑﺮد دارﻧﺪ.
اﺧﺘﻼف ﻋﻤﺪه ﺑﻴﻦاﺳﻴﺪﻫﺎي ﻧﻮﻛﻠﺌﻴﻚ و ﭘﺮوﺗﺌﻴﻦﻫﺎ از ﻳﻚ ﻃﺮف و ﭘﻠﻲ ﺳﺎﻛﺎرﻳﺪﻫﺎ و ﻟﻴﭙﻴﺪﻫﺎ اﻳـﻦ اﺳـﺖ ﻛـﻪ اﺳـﻴﺪﻫﺎي ﻧﻮﻛﻠﺌﻴـﻚ و ﭘﺮوﺗﺌﻴﻦﻫﺎ درﺷﺖ ﻣﻮﻟﻜﻮلهای آﮔﺎه ﻛﻨﻨﺪه ﻣﻲﺑﺎﺷﻨﺪ. زﻳﺮا از ﻧﻈﺮ ﺳﺎﺧﺘﻤﺎﻧﻲ ﺣﺎﻣﻞ اﻃﻼﻋﺎت ﻣﻲﺑﺎﺷﻨﺪ. ﻫﺮ ﻣﻮﻟﻜﻮل اﺳﻴﺪ ﻧﻮﻛﻠﺌﻴﻚ داراي 4 ﻧﻮع ﻣﻮﻧﻮﻧﻮﻛﻠﺌﻮﺗﻴﺪ اﺳﺖ ﻛﻪ ﺗﺮﺗﻴﺐ ﻗﺮار ﮔﺮﻓﺘﻦ آنها اﻃﻼﻋﺎت ﺗﻮارﺛﻲ را ﺑﻴﺎن ﻣﻲ ﻧﻤﺎﻳﺪ.
- ﻣﻮﻟﻜﻮلهاي ﭘﺮوﺗﺌﻴﻨﻲ داراي 20 ﻧﻮع اﺳﻴﺪ آﻣﻴﻨﻪ ﻣﻲﺑﺎﺷﻨﺪ ﻛﻪ ﺗﺮﺗﻴﺐ ﻗﺮار ﮔﺮﻓﺘﻦ آﻧﻬﺎ ﺧﻮد ﺑﻴﺎن اﻃﻼﻋﺎت ﺗﻮارﺛﻲ اﺳﺖ.
- ﭘﻠﻲ ﺳﺎﻛﺎرﻳﺪﻫﺎ و ﻟﻴﭙﻴﺪﻫﺎ از درﺷﺖ ﻣﻮﻟﻜلهای آﮔﺎه ﻛﻨﻨﺪه ﻧﻤﻲﺑﺎﺷﻨﺪ زﻳﺮا ﺳﺎﺧﺘﻤﺎن آنها درﺟﺎﻧﺪاران ﻣﺨﺘﻠﻒ ﻳﻜﺴﺎن اﺳﺖ.
ﻋﻨﺎﺻﺮ ﺳﺎزﻧﺪه ﺑﺪن ﻣﻮﺟﻮدات زﻧﺪه از ﻧﻈﺮ ﺗﻌﺪاد ﺑﻪ 2 دﺳﺘﻪmicro element وmacro element تقسیم میشوند.
-از ﻃﺮف دﻳﮕﺮي ﻋﻨﺎﺻﺮ در ﻳﻜﻲ از 3 ﮔﺮوه زﻳﺮ ﻗﺮار دارﻧﺪ:
1) ﻋﻨﺎﺻﺮ ﺳﺎﺧﺘﻤﺎﻧﻲ : ﺷﺎﻣﻞ 4 ﻋﻨﺼﺮ اﺻﻠﻲ ،(N-C-O-H) ﻣﻲﺑﺎﺷﺪ ﻛﻪ ﺗﻘﺮﻳﺒﺎ %99 وزن ﺑﻴﺸﺘﺮ ﺳﻠﻮلﻫﺎ را ﺗﺸﻜﻴﻞ ﻣﻲدﻫـﺪ در ﺻﻮرﺗﻴﻜﻪ ﻓﺮاوانترﻳﻦ ﻋﻨﺎﺻﺮ در روي ﻛﺮه زﻣﻴﻦ : (Na-A1-Si-O)ﻣﻲﺑﺎﺷﺪ. اﻧﺘﺨﺎب اﻳﻦ ﻋﻨﺎﺻﺮ ﺑﻪ ﻋﻨﻮان ﻋﻨﺎﺻﺮ ﺳﺎزﻧﺪه اﺣﺘﻤـﺎﻻً ﺑـﻪ اﻳﻦ دﻟﻴﻞ اﺳﺖ ﻛﻪ اﻳﻦ ﻋﻨﺎﺻﺮ ﻗﺎدر ﻣﻲﺑﺎﺷﻨﺪ ﺑﻪ ﺑﻬﺘﺮﻳﻦ وﺟﻪ ﺑﺎ ﻳﻜﺪﻳﮕﺮ ﺗﺮﻛﻴﺐ ﺷﺪه و ﺗﺮﻛﻴﺒﺎت ﭘﺎﻳﺪاري را ﺑﺮاي ﺑﻪ وﺟﻮد آوردن ﭘﺪﻳﺪهي ﺣﻴﺎت، ﻓﺮاﻫﻢ ﺳﺎزﻧﺪ.
2) ﻳﻮنها: ﺷﺎﻣﻞ ﻛﺎﺗﻴونها و آﻧﻴونها ﻣﺜﻞ: ﺳﺪﻳﻢ ، ﻛﻠﺮ، ﭘﺘﺎﺳﻴﻢ و .....
3) ﻋﻨﺎﺻﺮ ﻛﻤﻴﺎب : ﺷﺎﻣﻞ آﻫﻦ، ﻣﺲ، ﻛﺒﺎﻟﺖ، روي، ﻛﺮم، ﻣﻮﻟﻴﺒﺪن، ﻣﻨﮕﻨﺰ و ......
آب و پتانسيل هيدروژن
آب جزء شيميايي اصلي موجودات زنده است. خواص فيزيكي منحصر به فرد آن از جمله قابليت حل كردن گسترة وسيعي از مولكولهاي آلي و معدني، ناشي از ساختار دوقطبي و ظرفيت استثنايي آن در ايجاد پيوندهاي هيدروژني و همين طور ثابت دي الكتريك بالاي آن است. نحوهي تعامل آب با هر بيومولكول بر ساختار هركدام از آنها تاثير ميگذارد. آب يكنوكلئوفيل بسيارعالي است كه در بسياري از واكنشهاي متابوليك نقش واكنشگر يا محصول را دارد. آب تمايل مختصري دارد كه به يونهاي هيدروكسيد و پروتون تفكيك شود.
اسيدیتهي محلول هاي آلي را عموماً با مقياس لگاريتميPHبيان ميكنند. در حالت طبيعي بيكربناتها و ساير بافرها PHمايع خارج سلولي را در محدودهي 35/7 تا 45/7 نگه ميدارند.7براي تاييد اختلالات تعادل اسيد و باز از سنجشPH خون شرياني وCO2 خون وريدي استفاده ميكنند.
آب بدن در سه محيط متمايز فضاي درون سلولي (حدود 40 % وزن بدن ) و فضاي بين سلولي (حدود 15 % وزن بدن ) و درون رگها و آب پلاسمايي (حدود 5% وزن بدن ) وجود دارد.
پيوندهاي هيدروژني به مولكولهای آب اجازه ميدهد تا بسياري از بيومولكولها را در خود حل كنند كه داراي گروههاي فعال شده كيت كننده در پيوندهيدروژني هستند. اتم هاي اكسيژن آلدئيدها ، كتونها و آميدها، جفت الكترونهايي دارند كه مي توانند نقش پذيرنده ي هيدروژن را ايفا كنند. الكلها و آمينها ، هم ميتوانند نقش پذيرنده و هم نقش دهندهي اتم هيدروژن بي حفاظ را براي ايجاد پيوند هيدروژني ايفا كنند. اجسامي كه تواماً داراي عوامل قطبي و هيدروفوب قوي هستند،آمفي پاتيك نام دارد و اغلب اين اجسام مانند اسيدهاي چرب و ليپيدهاي قطبي ميل به تشكيل میسل دارند.
نخستين بار سورننسPH اصطلاح را در سال 1909 به كاربرد و به صورت لگاريتم منفي يون هيدروژن تعريف كرد.
pH=-log[H+]
شکل پروتوندار هر اسید (مانندHA یاRNH3+) را اسید، و فرم فاقد پروتون (A- یاRNH2) را باز مزدوج همان اسید مینامند. به همین ترتیب میتوان باز و اسید مزدوج را نیز تعریف کرد. اما معادلهای که رفتار زوجهای اسید و بازی را مشخص میکند، معادلة هندرسون-هسلباخ نام دارد که به شرح زیر است:
pH= pKa + log ([A-][HA])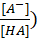
محلول بازها يا اسيدهاي ضعيف و مزدوج آنهاخاصيت بافري دارد. يعني پس از افزودن اسيد يا باز قوي به محلول، توان بيشتري در مقابله با تغييرpH دارد، از آنجا كه بسياري از واكنشهاي متابوليك با آزاد سازي يا برداشت پروتون همراهند اكثر واكنشهاي داخلسلولي بافر ميشوند.
ﻣﺘﺎﺑﻮﻟﻴﺴﻢ اﻛﺴﻴﺪاﺗﻴﻮ،CO2 ﺗﻮﻟﻴﺪ ﻣﻲﻛﻨﺪ ﻛﻪ اﻳﻨﺪرﻳﺪ اﺳﻴﺪ ﻛﺮﺑﻨﻴﻚ اﺳﺖ و در ﺻﻮرت ﺑﺎﻓﺮ ﻧﺸﺪن ﺑﺎﻋﺚ اﺳﻴﺪوز ﺷـﺪﻳﺪ ﺧﻮاﻫـﺪ ﺷـﺪ. ﺣﻔﻆ ﺛﺒﺎت PHﻣﺴﺘﻠﺰم ﺑﻪ ﻛﺎرﮔﻴﺮي ﺑﺎﻓﺮﻫﺎي ﻓﺴﻔﺎت، ﺑﻴﻜﺮﺑﻨﺎت و ﭘﺮوﺗﺌﻴﻦﻫﺎﺳﺖ ﻛﻪ ﭘﺮوﺗﻦﻫﺎ را ﻣﻲ ﭘﺬﻳﺮﻧﺪ ﻳﺎ آزاد ﻣﻲ ﻛﻨﻨﺪ ﺗﺎ ﺑﺎ ﺗﻐﻴﻴـرpH ﻣﻘﺎﺑﻠﻪ ﻛﻨﻨﺪ.
ﻧﻜﺘﻪي آﺧﺮ اﻳﻨﻜﻪ ﺑﺎﻓﺮ ﺷﺪن را زﻣﺎﻧﻲ ﺑﺎPH ﺳﻨﺞ ﻣﻲﺗﻮان دﻳﺪ ﻛﻪ ﻳﻚ اﺳﻴﺪ ﻳﺎ ﺑﺎز ﺿﻌﻴﻒ در ﺣﺎل ﺗﻴﺘﺮاﺳﻴﻮن ﺑﺎﺷﺪ.
برای تسلط بیشتر بر این مباحث، میتوانیددورۀ آموزشی بیوشیمیلینوم را مشاهده کنید.